Przestrzeń peryplazmatyczna, to przestrzeń między błoną wewnętrzną a błoną zewnętrzną u bakterii Gram-ujemnych. U bakterii Gram-dodatnich jest ona mniejsza i znajduje się między błoną wewnętrzną, a warstwą peptydoglikanu [1]. Jak bardzo jest istotna i jakie funkcje pełni w komórce bakteryjnej? Na te pytania postaramy się odpowiedzieć w tym artykule.
Spis treści
Peryplazma u bakterii Gram-ujemnych
Peryplazma to region zawierający peptydoglikan otoczony błoną wewnętrzną i zewnętrzną. Zapewnia środowisko utleniające dzięki czemu struktura białek może być stabilizowana przez wiązanie disulfidowe [1,2].
Tego terminu po raz pierwszy w mikrobiologii użył Mitchell. On i inni naukowcy w latach sześćdziesiątych XX wieku chcieli zrozumieć jak toksyczne enzymy, które są zaangażowane w degradację istotnych cząsteczek biologicznych (np. rybonukleazy, fosfatazy) produkowane przez Escherichia coli nie są toksyczne dla samej komórki. Uformowali sferoplasty, dzięki którym zaobserwowali uwolnienie enzymów degradujących oraz przeprowadzili zimny szok osmotyczny po czym znaleźli białka transporterów ABC. Na tej podstawie stwierdzono, że u Gram-ujemnych bakterii poza błoną cytoplazmatyczną znajduje się jakiś dodatkowy przedział, który zawiera inne spektrum enzymów [1,2,3].
Funkcje peryplazmy
Białka peryplazmatyczne są początkowo transportowane przez błonę cytoplazmatyczną. Translokacja odbywa się przez dwa systemy sekrecyjne Sec i Tat (już o nich wspomniano w rozdziale o holinach) [2]. Pełni ona wiele funkcji, nie tylko anty-toksyczną, jak myślano na początku. Poniżej znajduje się lista znanych nam dziś funkcji peryplazmy:
- utlenianie białek,
- sekrecja białek,
- fałdowanie białek,
- sekrecja Lipopolisacharydu do błony zewnętrznej,
- sekrecja lipoprotein,
- proteaza,
- fosfataza,
- nukleaza,
- fosfolipaza,
- wyczuwanie środowiska,
- utrzymanie potencjału Donnana przez błonę zewnętrzną,
- synteza peptydoglikanu,
- maszyneria podziału komórki,
- odpowiedź na stres otoczki,
- transporter ABC,
- wirnik wiciowy,
- redukcja azotanów,
- biosynteza molibdenu i włączanie go do enzymów,
- transport elektronów,
- osmoregulacja,
- transport żelaza i metali,
- wyczuwanie i oporność na kationowe peptydy antymikrobiologiczne [3].
Rozmiar peryplazmy
Grupa Kelly Hughes pokazała w swoich badaniach, że rozmiar peryplazmy, albo też dystansu między błonami jest kontrolowany przez lipoproteinę Brauna (występuje ona tylko u bakterii Gram-ujemnych), która łączy kowalentnie błonę zewnętrzną z warstwą peptydoglikanu.
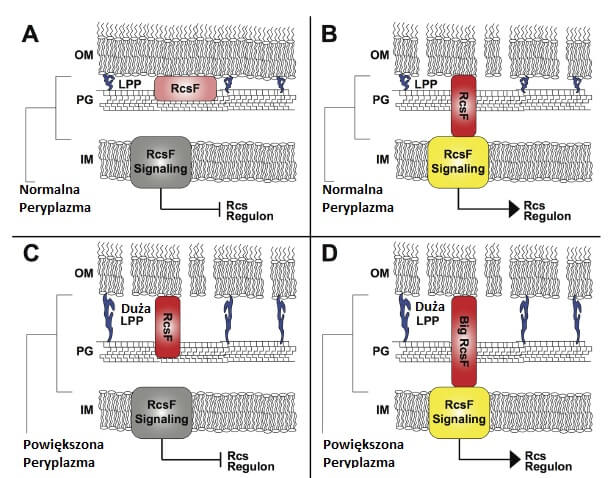
Okazuje się, że rozmiar peryplazmy ma istotne znaczenie dla systemu kontroli stresu otoczki. Konkretnie dla Regulatora syntezy otoczki F (ang. Regulator of capsule synthesis F – RcsF), który odpowiada za wyczuwanie nieprawidłowości i zniszczenia w otoczce. Jeśli dojdzie do uszkodzenia otoczki, to system Rcs aktywuje syntezę zewnątrzkomórkowego polisacharydu, by zapewnić komórce bezpieczeństwo i rozpoczyna formowanie biofilmu. Lipoproteina RcsF oddziałuje z białkami sygnałowymi ze specyficznymi domenami peryplazmatycznymi na uszkodzoną otoczkę i stres peptydoglikanu, by aktywować syntezę zewnątrzkomórkowego polisacharydu, a także inne ścieżki obronne. Wymaga to, aby peryplazma posiadała określony rozmiar (Ryc. 1) [3].
Peryplazma u bakterii Gram-dodatnich
W przypadku bakterii Gram-dodatnich ze względu na brak w ich budowie błony zewnętrznej definicja peryplazmy wygląda nieco inaczej. Jest to przestrzeń między zewnętrzną stroną błony cytoplazmatycznej a wewnętrzną stroną peptydoglikanu.
Obecność tej struktury wciąż jest dla niektórych częścią sporną, ale jest coraz więcej dowodów przemawiających za tym, że musi ona istnieć. Jednym z argumentów przemawiającym za tym, że przestrzeń peryplazmatyczna jest obecna u Gram-dodatnich bakterii jest potrzeba miejsca na maszynerię syntezy peptydoglikanu. Na tę maszynerię nie ma miejsca w błonie cytoplazmatycznej.
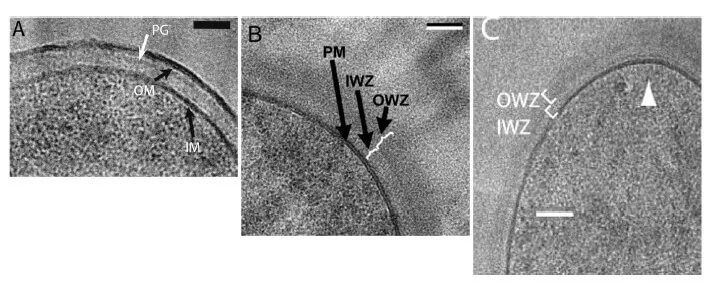
Krioskrawkowa mikroskopia elektronowa (krioEM) pokazała (Ryc. 2), że w przypadku bakterii Gram-dodatnich występuje przestrzeń peryplazmatyczna, natomiast nie można już było jej zaobserwować w technice tomograficznej krioEM. Nie wiadomo co może powodować, że w niektórych badaniach widać tę przestrzeń u Gram-dodatnich bakterii a w niektórych nie.
Literatura
- https://www.uniprot.org/locations/SL-0200
- Koch, A. L. (1998). The biophysics of the gram-negative periplasmic space. Critical reviews in microbiology, 24(1), 23-59.
- Merdanovic, M., Clausen, T., Kaiser, M., Huber, R., & Ehrmann, M. (2011). Protein quality control in the bacterial periplasm. Annual review of microbiology, 65, 149-168. DOI: 10.1146/annurev-micro-090110-102925.
- Miller, S. I., & Salama, N. R. (2018). The gram-negative bacterial periplasm: Size matters. PLoS biology, 16(1), e2004935. DOI: 10.1371/journal.pbio.2004935.
- Erickson, H. P. (2021). How teichoic acids could support a periplasm in gram-positive bacteria, and let cell division cheat turgor pressure. Frontiers in microbiology, 12, 664704. DOI: 10.3389/fmicb.2021.66470410.3389/fmicb.2021.664704.
