Pinholiny są produktem genów fagów, które także kodują endolizyny z domeną SAR (signal anchor release). Są one swoistymi zegarami, które kontrolują czas, w którym ma dojść do lizy komórki gospodarza.
Spis treści
Opis pinholin
Pinholiny należą do drugiej klasy holin. Tworzą one mini otwory, dziurki o średnicy <2 nm w błonie wewnętrznej komórki bakteryjnej. Nie są zdolne do utworzenia na tyle dużych otworów, aby mogły być przez nie transportowane endolizyny. Natomiast poprzez utworzenie dziurek doprowadzają do zaburzenia gradientu protonowego błony a co za tym idzie do jej depolaryzacji. To pozwala endolizynom z domeną SAR, która jest zakotwiczona w błonie wewnętrznej komórki bakteryjnej, na ich uwolnienie do peryplazmy i prawidłowe sfałdowanie się endolizyn do aktywnej formy. Dobrze poznaną pinholiną jest białko S2168, które jest produktem genu S21 lambdoidalnego bakteriofaga 21.
Budowa pinholin
Enzymy te zbudowane są z dwóch domen transmembranowych (TMD1 i TMD2). TMD1 to N-końcowa sekwencja sygnałowa, która jest inhibitorem dla domeny TMD2 w pozycji trans. Domena ta nie jest związana z błoną i nie bierze udziału w tworzeniu dziurek, ale za to pełni funkcję regulacyjną. Z kolei domena TMD2 jest związana z błoną wewnętrzną komórki gospodarza i bierze udział w formowaniu dziurek (Ryc. 1).
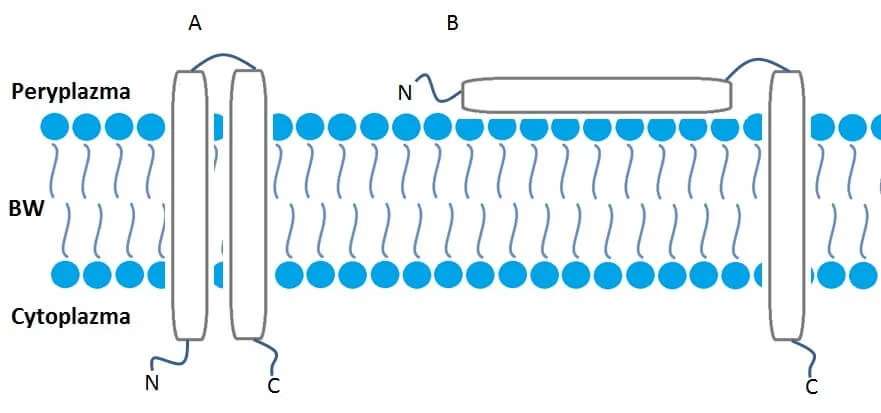
Mechanizm działania pinholin
Gdy tylko geny późnej lizy bakteriofaga ulegają ekspresji N-końcowa domena TMD1 częściowo opuszcza błonę wewnętrzną i przedostaje się do peryplazmy. To doprowadza do aktywacji domeny TMD2, która zaczyna się akumulować w błonie w postaci dimerów. Po przekroczeniu stężenia krytycznego z dimerów tworzą się oligomery (tzw. tratwy) a potem heptamery, które tworzą dziurki. Szacuje się, że około 16 tratw zwierających około 60 heptamerycznych dziurek jest formowanych w błonie wewnętrznej komórki bakteryjnej. Wytworzone dziurki zaburzają gradient protonowy błony prowadząc do jej depolaryzacji.
Literatura
- Ahammad, T., Drew, D.L., Sahu, I.D., Khan, R.H., Butcher, B.J., Serafin, R.A., Galende, A. P., McCarrick, R.M., Lorigan, G.A., 2020. Conformational differences are observed for the active and inactive forms of Pinholin S21 using DEER spectroscopy. J. Phys. Chem. B 124, 11396–11405. https://doi.org/10.1021/acs.jpcb.0c09081.
- Grabowski Ł, Łepek K, Stasiłojć M, Kosznik-Kwaśnicka K, Zdrojewska K, Maciąg-Dorszyńska M, Węgrzyn G, Węgrzyn A. (2021) Bacteriophage-encoded enzymes destroying bacterial cell membranes and walls, and their potential use as antimicrobial agents. Microbiological Research; 248:126746. DOI: 10.1016/j.micres.2021.126746.
- Woźnica, W. M., Bigos, J., & Łobocka, M. B. (2015). Liza komórek bakteryjnych w procesie uwalniania bakteriofagów–kanoniczne i nowo poznane mechanizmy. Postępy Higieny i Medycyny Doświadczalnej, 69, 114-126; PMID: 25614679.
