Holiny można nazwać zegarami baketriofaga, które odliczają czas do lizy komórki bakteryjnej przez uwolnienie endolizyn z cytoplazmy do peryplazmy odblokowując dostęp do peptydoglikanu.
Spis treści
Charakterystyka holin
Holiny to małe hydrofobowe białka zakodowane w genomie fagowym, które lokalizują się w błonie wewnętrznej komórki bakteryjnej w formie homodimerów. Nazywa się je tak ze względu na ich funkcję – po osiągnięciu stężenia krytycznego białka aktywują się i tworzą otwory w błonie wewnętrznej komórki bakteryjnej. Prowadzi to do załamania siły napędowej protonów błony komórkowej. Otwory tworzone przez holiny są odpowiednio duże (200 – 400 nm, co pozwala na przedostanie się białek do 500 kDa), aby umożliwić endolizynom przedostanie się do peryplazmy.
Podział holin
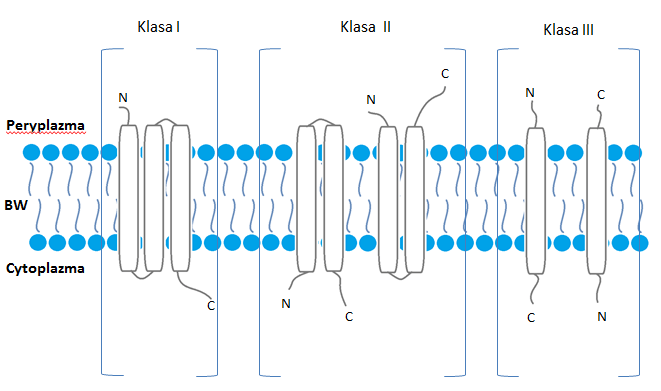
Holiny charakteryzują się niskim poziomem podobieństwa w sekwencji, aczkolwiek wykazują pewne podobieństwa w budowie. Ich wielkość mieści się zazwyczaj w przedziale między 60-155 aminokwasów. Posiadają dodatnio naładowany polarny C-koniec i hydrofobowy N-koniec. Ze względu na ilość domen transmembranowych (TMD) można podzielić je na 3 klasy.
I klasa holin
- Zawiera 3 TMD
- O wielkości 95-130 aminokwasów
- N-koniec białka znajduje się w peryplazmie a hydrofilny C-koniec w cytoplazmie
- Sztandarowy przykład tej klasy holin to S105 występująca w fagu λ
Innymi przykładami tej klasy to HolSMP pochodząca z faga SMP infekującego Streptococcus suis, albo holina Y z faga P2.
II klasa holin
- Zawiera 2 TMD
- O wielkości 65-95 aminokwasów
- Oba końce białka koniec białka znajdują się jednocześnie w cytoplazmie (np. HolTW), albo w peryplazmie (np. Hol3626)
Inne przykłady to: holina S21 lamdoidalnego faga 21, albo gp17 z faga T7
III klasa holin
- Posiada 1 TMD
- Posiadają wysoką zawartość reszt hydrofilowych
- C-koniec znajduje się w peryplazmie a N-koniec w cytoplazmie komórki bakteryjnej (np. holina T z faga T4) bądź odwrotnie (np. Siskin)
Antyholiny
Dla prawidłowego działania zegara litycznego bardzo ważną funkcję pełnią antagoniści holin, czyli antyholiny. Ich sekwencja może być kodowana przez ten sam gen, co holinę, bądź być produktem osobnego genu. Mogą występować jako białka błonowe, cytoplazmatyczne, albo takie, które występują w peryplazmie. Nieobecność tych białek spowodowałaby przedwczesną lizę komórki bakteryjnej (przed złożeniem wirionów).
Regulacja czasu lizy
Działanie zegara litycznego na przykładzie holiny S105 i antyholiny S107 faga λ
Holina S105 połączona z antyholiną S107 tworzą heterodimery. Różnica w budowie S107 nie pozwala na tworzenie się porów w błonie, ani na odblokowanie tej możliwości. Poza tym, że tworzą się heterodimery w tym samym czasie pojawiają się także homodimery i dopiero po osiągnięciu przez nie stężenia krytycznego może dojść do powstania pierwszego otworu. Obecność antyholiny przeszkadza w zbyt szybkim osiągnięciu stężenia krytycznego przez holiny S105 i przedwczesnej lizie komórki. Po zachwianiu polarności błony komórki bakterynej w antyholinie dochodzi do zmian konformacyjnych i staje się aktywną holiną a obecne heterodimery przekształcają się w formę homodimerów, co usprawnia tworzenie dziur a tym samym depolaryzację błony.
Model „death raft”
Według tego modelu holiny akumulują się w formie homodimerów przy błonie cytoplazmatycznej. Po osiągnięciu stężenia krytycznego domeny transmembranowe wchodzą ze sobą w interakcje tworząc tak zwane tratwy. Wypierają przy tym lipidy, które wchodzą w skład błony i tworzą małe kanały. W takich miejscach błona komórkowa ulega depolaryzacji, holiny zmieniają swoją konformację i w obrębie tratw przegrupowują się co powoduje powstanie większych otworów. Na całej długości błony powstaje kilka takich skupisk.
Inne funkcje holin
Świat enzymów fagowych wciąż jest obiektem badań. W przypadku holin zauważa się coraz więcej przypadków, które wskazują na to, że są zdolne nie tylko do tworzenia otworów w błonie komórkowej. Mogą także transportować białka nie doprowadzając do dużych uszkodzeń błony i lizy komórki bakteryjnej.
Są dwie główne drogi translokacji białek:
- System sekrecji (Sec) dla białek niesfałdowanych
- Bliźniacza translokacja argininy ( twin-arginine translocationa Tat) do transportu białek sfałdowanych
Holiny odpowiadają drodze Tat. Okazuje się, że Gram-ujemne bakterie wykorzystują pochodzący od profaga nielityczny system holina-endolizyna do miejscowej permeabilizacji ściany komórkowej w celu sekrecji białek. W tym momencie nie wiemy, czy w przypadku bakterii Gram-ujemnych możliwy jest transport innych białek niż endolizyny, ale sugeruje się, że jest to możliwe ze względu na rodzaj drogi transportu. W przypadku bakterii Gram-dodatnich powiązanych z Clostridium brak systemu Tat spowodował, że zaadaptowały one system holinowy także do transportu toksyn i bakteriocyn.
Jeśli chodzi o endolizyny, to działają one jako drugi substrat obok holin i ich funkcja polega na miejscowej permeabilizacji ściany komórkowej w przypadku bakterii Gram-ujemnych. Zdarza się także, że gen endolizyny powiązany z genem holiny zostaje pofragmentowany albo ulega delecji a wydzielone białka przedostają się przez ścianę komórkową alternatywną drogą.
Zastosowanie holin
Holiny posiadają zdolność do uszkadzania błony komórki bakteryjnej. Holina HOLGH15 z faga GH15 jest aktywna litycznie wobec Staphylococcus auresus i Listeria monocytogenes. Udowodniono także, że ta holina jest zdolna do lizy L. monocytogenes także w warunkach panujących w lodówce. Stąd można przypuszczać, że mogą znaleźć zastosowanie w ochronie żywności.
Holiny są także pomocne w produkcji potencjalnych szczepionek. Stworzono puste duchy bakteryjne poprzez ekspresję genów kodujących holinę i endolizynę faga λ razem z genem kodującym białko lityczne E faga φX174. Te bakteryjne duchy są w stanie wywołać odpowiedź komórkową jak i humoralną układu odpornościowego, więc w przyszłości mogą służyć jako wektor jakiejś szczepionki.
Literatura
- Aslam B, Arshad MI, Aslam MA, Muzammil S, Siddique AB, Yasmeen N, Khurshid M, Rasool M, Ahmad M, Rasool MH, Fahim M, Hussain R, Xia X, Baloch Z. (2021) Bacteriophage Proteome: Insights and Potentials of an Alternate to Antibiotics. Infectious Diseases and Therapy. 10(3):1171-1193. doi: 10.1007/s40121-021-00446-2.
- Brüser, T., & Mehner-Breitfeld, D. (2022). Occurrence and potential mechanism of holin-mediated non-lytic protein translocation in bacteria. Microbial cell: the journal for unicellular biology and modeling of human disease 9 (2022), Nr. 10, 9(10), 159-173; doi:10.15698/mic2022.10.785
- Grabowski Ł, Łepek K, Stasiłojć M, Kosznik-Kwaśnicka K, Zdrojewska K, Maciąg-Dorszyńska M, Węgrzyn G, Węgrzyn A. (2021) Bacteriophage-encoded enzymes destroying bacterial cell membranes and walls, and their potential use as antimicrobial agents. Microbiological Research; 248:126746. DOI: 10.1016/j.micres.2021.126746.
- Tran, T. A. T., Struck, D. K., & Young, R. (2005). Periplasmic domains define holin-antiholin interactions in T4 lysis inhibition. Journal of bacteriology, 187(19), 6631-6640. doi:10.1128/JB.187.19.6631–6640.2005
- Wang, I. N., Smith, D. L., & Young, R. (2000). Holins: the protein clocks of bacteriophage infections. Annual Reviews in Microbiology, 54(1), 799-825. doi:10.1146/annurev.micro.54.1.799
- Woźnica, W. M., Bigos, J., & Łobocka, M. B. (2015). Liza komórek bakteryjnych w procesie uwalniania bakteriofagów–kanoniczne i nowo poznane mechanizmy. Postępy Higieny i Medycyny Doświadczalnej, 69, 114-126; PMID: 25614679.
