Bakteriofagi podczas ostatniego etapu cyklu litycznego uwalniają potomne wiriony. Proces ten może być zależny od kilku enzymów, które kodowane są przez fagi. Są to endolizyny, holiny i spaniny. Dziś przybliżymy sobie nieco temat endolizyn.
Spis treści
Charakterystyka endolizyn
Endolizyny to małe białka zwane także hydrolazami peptydoglikanu. Tną one bakteryjny peptydoglikan pod koniec cyklu litycznego. Peptydoglikan nadaje komórce bakteryjnej odpowiedni kształt, a co więcej zapewnia komórce ochronę przed wysokim ciśnieniem osmotycznym. Po utracie tej struktury komórka bakteryjna narażona jest na działanie zwiększonego ciśnienia, w związku z czym następuje jej liza. Endolizyny są specyficzne wobec substratu, dlatego też stanowią ciekawy obiekt badań. Ponadto działają na komórki bakteryjne po zewnętrznej aplikacji i można je zastosować w medycynie, albo w ochronie żywności przed patogenami.
Budowa endolizyn
Budowa komórki bakterii Gram-ujemnej i Gram-dodatniej różni się od siebie. W związku z tym endolizyny, które pochodzą od fagów infekujących baterie Gram-ujemne zwykle różnią się budową od tych infekujących bakterie Gram-dodatnie.
Endolizyny, które pochodzą od fagów infekujących bakterie Gram-ujemne zazwyczaj są globularnymi białkami o wielkości od 15 do 20 kDa. Posiadają jedną domenę aktywną enzymatycznie, ale w swojej strukturze mogą także posiadać miejsca odpowiadające za interakcję z peptydoglikanem. Przykładem takiej endolizyny jest LysABP-01, która pochodzi od bakteriofaga ØABP-01 infekującego Acinetobacter baumannii. Jednak w świecie fagów, których gospodarzami są bakterie Gram-ujemne także można spotkać się z endolizynami modularnymi. Przykładem takiej endolizyny jest KZ144, która pochodzi od faga infekującego Pseudomonas aeruginosa. Posiada ona domenę aktywną enzymatyczne (EAD) oraz domenę wiążącą peptydoglikan (CBD).

W przypadku endolizyn, które pochodzą od fagów infekujących bakterie Gram-dodatnie najczęściej mamy do czynienia z modularną budową tych białek. W związku z tym ich masa molekularna jest trochę większa i zwykle wynosi od 25-40 kDa. Ich domena katalityczna znajduje się na N-końcu białka a domena wiążąca peptydoglikan na C-końcu. Zdarza się jednak, że białko posiada więcej niż jedną domenę katalityczną, albo wiążącą. Przykładem jest endolizyna λSA2, która posiada domenę wiążącą w centrum białka i otoczona jest przez dwie domeny katalityczne.
Większość endolizyn jest produktem jednego genu. Znaleziono jednak odstępstwo od tej reguły. Endolizyna PlyC, pochodząca ze strepokokowego faga C1, jest produktem dwóch genów plyCA i plyCB. Dokładniej rzecz ujmując holoenzym PlyC jest utworzony z podjednostki PlyCA zawierającej w sobie dwie domeny katalityczne i ośmiu podjednostek PlyCB tworzącym domenę wiążącą. Masa molekularna całego białka wynosi aż 114 kDa.
Enzymatyczna aktywność endolizyn
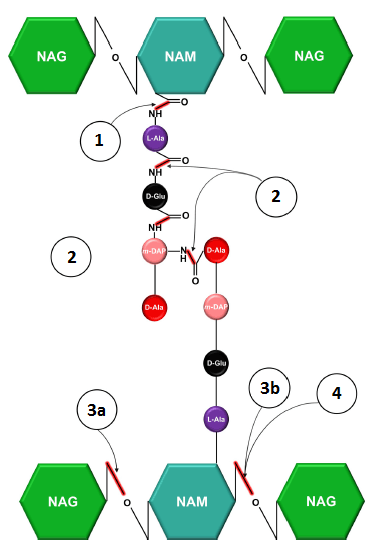
Endolizyny można podzielić na pięć klas pod względem miejsca cięcia peptydoglikanu. Pierwsze z nich to amidazy N-acetylomuramylo-L-alaninowe (1 na ryc. 3), która występuje najbardziej powszechnie spośród wszystkich endolizyn. Tnie wiązanie amidowe pomiędzy peptydem macierzystym, a kwasem N-acetylomuraminowym. Endopeptydazy (2 na ryc. 3) hydrolizują wiązanie peptydowe pomiędzy aminokwasami. N-acetylo-β-glukozaminidazy (3 na ryc. 3) hydrolizują wiązanie N-acetyloglukozaminylo-β-1,4-N-acetulomuraminowe na redukującym końcu N-acetyloglukozaminy (NAG). N-acetylomuramidazy (3b na ryc. 3) tną wiązanie N-acetylumuramylo-β-1,4-N-acetyluglukozaminowe pomiędzy NAG a kwasem N-acetylomuraminowym (NAM). Lityczne transglikozylazy (4 na ryc. 3.) działają podobnie, jak N-acetylomuramidazy, ale nie hydrolizują wiązania i ich końcowy produkt jest inny.
Domena SAR
Endolizyny mogą przedostać się przez błonę wewnętrzną do peptydoglikanu dzięki holinom. Istnieją też endolizyny kodowane przez niektóre fagi z dwuniciowym DNA, które posiadają sekwencje sygnałowe – SAR (Signal Anchor Release) na N-końcu. Mogą przedostać się przez błonę wewnętrzną do peryplazmy wykorzystując bakteryjny system sekrecyjny (sec). Te enzymy możemy podzielić na trzy klasy i różnią się one budową centrum katalitycznego.
Endolizyna z domeną SAR początkowo znajduje się w formie nieaktywnej. Domena SAR zakotwiczona jest w błonie a domena katalityczna znajduje się w peryplazmie. Aktywacja endolizyn z domeną SAR jest powiązana z pinholinami. Pinholony tworzą mini otwory doprowadzając do zaburzeń w gradiencie protonowym błony a co za tym idzie do jej depolaryzacji. W rezultacie domena SAR, która była zakotwiczona w błonie uwalnia się, co skutkuje zmianą konformacji endolizyny do formy aktywnej.
Zastosowanie endolizyn
Endolizyny mają przede wszystkim działanie bakteriobójcze, co w dobie wielolekooporności bakterii stanowi dobry znak. Na dodatek, w przeciwieństwie do antybiotyków, endolizyny są specyficzne wobec substratu. Pozwoli to na niszczenie patogenów z zachowaniem prawidłowej mikrobioty jelit pacjenta.
Endolizyny mogą działać synergistycznie ze sobą, ale także z innymi substancjami, np. takimi, które permeabilizują błonę komórkową bakterii zwiększając jej przepuszczalność, czy antybiotykami (dlatego nie należy ich ostatecznie przekreślać).
Jedna z endolizyn, CF-301, od 2019 roku znajduje się w III fazie badań klinicznych w celu leczenia systemowej bakteriemii i zapalenia wsierdzia, które zostały spowodowane przez Staphylococcus aureus (w sumie są cztery fazy, z czego czwarta faza obejmuje lek, który już dostał pozwolenie na wprowadzenie do obrotu). Endolizyna ma szerokie spektrum działania na bakterie S. aureus w tym oporne na metycylinę (MRSA).
Naukowcy także opracowali chimeryczne białka, aby zwiększyć aktywność lityczną białek oraz ich specyficzność. Staphepfekt SA.100 jest zmodyfikowaną endolizyną fagową o aktywności endopeptydazy i przypuszczalną aktywnością amidazy. Została zaprojektowana z myślą o leczeniu infekcji skórnych spowodowanych przez S. aureus wliczając w to szczepy MRSA oraz MSSA (S. aureus wrażliwy na metcylinę).
Szybka detekcja patogenów jest jednym z kluczowych elementów przy wdrożeniu leczenia zakażeń bakteryjnych. Wykorzystanie zdolności endolizyn do wiązania peptydoglikanu okazuje się tutaj zbawienne. Ketzer i inni zaproponowali sposób na wykrywanie bakterii Listeria monocytogenes (wywołuje ona jedną z zoonoz, listeriozę). Kulki magnetyczne można okryć domenami CBD, które by pochodziły z różnych endolizyn fagów infekujących bakterie Listeria. Wskaźniki wykrywalności wynosiłyby ponad 90%, co daje lepsze wyniki niż standardowa metoda posiewu pod względem czułości a także szybkości testu.
Kontaminacja żywności patogenami, to inny poważny problem z jakim ludzkość musi się mierzyć. Endolizyny można zastosować także w ochronie żywności. Najlepiej sprawdzą się tutaj endolizyny stabilne termicznie, ponieważ takie białka są oporne na działanie proteolizy, czy denaturacji chemicznej. Poza tym żywność poddaje się obróbce termicznej, np. mleko, więc endolizyny znoszące wysokie temperatury, jak Ts2631, czy Ph2119 sprawdziłyby się najlepiej.
Istnieje jeszcze kilka obszarów, jak np. rolnictwo, w których można wykorzystać endolizyny. Mają one bardzo szerokie zastosowanie, jednak nadal wiele pracy stoi przed naukowcami, aby je dobrze scharakteryzować.
Literatura
- Grabowski Ł, Łepek K, Stasiłojć M, Kosznik-Kwaśnicka K, Zdrojewska K, Maciąg-Dorszyńska M, Węgrzyn G, Węgrzyn A. (2021) Bacteriophage-encoded enzymes destroying bacterial cell membranes and walls, and their potential use as antimicrobial agents. Microbiological Research; 248:126746. DOI: 10.1016/j.micres.2021.126746.
- Danis-Wlodarczyk KM, Wozniak DJ, Abedon ST. (2021) Treating Bacterial Infections with Bacteriophage-Based Enzybiotics: In Vitro, In Vivo and Clinical Application. Antibiotics; 10(12):1497. DOI: 10.3390/antibiotics10121497.
- Indiani C, Sauve K, Raz A, Abdelhady W, Xiong YQ, Cassino C, Bayer AS, Schuch R. (2019) The Antistaphylococcal Lysin, CF-301, Activates Key Host Factors in Human Blood To Potentiate Methicillin-Resistant Staphylococcus aureus Bacteriolysis. Antimicrobial Agents and Chemotherapy.; 63(4):e02291-18. DOI: 10.1128/AAC.02291-18.
- McGowan S, Buckle AM, Mitchell MS, Hoopes JT, Gallagher DT, Heselpoth RD, Shen Y, Reboul CF, Law RH, Fischetti VA, Whisstock JC, Nelson DC. (2012) X-ray crystal structure of the streptococcal specific phage lysin PlyC. Proceedings of the National Academy of Sciences U S A.; 109(31):12752-7. DOI: 10.1073/pnas.1208424109.
- Plotka M, Kaczorowska AK, Stefanska A, Morzywolek A, Fridjonsson OH, Dunin-Horkawicz S, Kozlowski L, Hreggvidsson GO, Kristjansson JK, Dabrowski S, Bujnicki JM, Kaczorowski T. (2014) Novel highly thermostable endolysin from Thermus scotoductus MAT2119 bacteriophage Ph2119 with amino acid sequence similarity to eukaryotic peptidoglycan recognition proteins. Applied and Environmental Microbiology; 80(3):886-95. DOI: 10.1128/AEM.03074-13.
- Plotka M, Kapusta M, Dorawa S, Kaczorowska AK, Kaczorowski T. (2019) Ts2631 Endolysin from the Extremophilic Thermus scotoductus Bacteriophage vB_Tsc2631 as an Antimicrobial Agent against Gram-Negative Multidrug-Resistant Bacteria. Viruses. 11(7):657. DOI: 10.3390/v11070657.
- Rahman MU, Wang W, Sun Q, Shah JA, Li C, Sun Y, Li Y, Zhang B, Chen W, Wang S. (2021) Endolysin, a Promising Solution against Antimicrobial Resistance. Antibiotics; 10(11):1277. DOI: 10.3390/antibiotics10111277.
- Thummeepak R, Kitti T, Kunthalert D, Sitthisak S. (2016) Enhanced Antibacterial Activity of Acinetobacter baumannii Bacteriophage ØABP-01 Endolysin (LysABP-01) in Combination with Colistin. Frontiers in Microbiology. DOI: 10.3389/fmicb.2016.01402.
- Woźnica, W. M., Bigos, J., & Łobocka, M. B. (2015). Liza komórek bakteryjnych w procesie uwalniania bakteriofagów–kanoniczne i nowo poznane mechanizmy. Postępy Higieny i Medycyny Doświadczalnej, 69, 114-126; PMID: 25614679.