Bakteriofagi, tak jak inne organizmy także posiadają określone cykle życiowe. W sumie znamy ich 4 i omówimy je w poniższym artykule.
Spis treści
Cykle życiowe fagów
Znamy kilka cykli życiowych bakteriofagów: lityczny, lizogeniczny, pseudolizogeniczny i przewlekłej infekcji. Mimo różnic w każdym z tych cykli, możemy wyróżnić kilka cech wspólnego przebiegu tych procesów:
- adsorpcja faga do powierzchni komórki gospodarza,
- wniknięcie materiału genetycznego faga do wnętrza komórki,
- powielenie wirionów,
- uwolnienie ich i dalszą transmisję fagów.
W cyklu litycznym, jak z nazwy wynika, następuje liza komórki gospodarza. Natomiast w cyklu lizogenicznym bakteriofag wbudowuje się do materiału genetycznego gospodarza, dzięki czemu powstaje profag. Fag wbudowany do chromosomu bakteryjnego może w ten sposób nadać komórce bakteryjnej dodatkowe cechy, np. oporność na antybiotyk. Istnieją fagi, które mogą przechodzić oba te cykle w zależności od panujących warunków, przykładem takiego faga jest bakteriofag λ [Ryc. 1.].
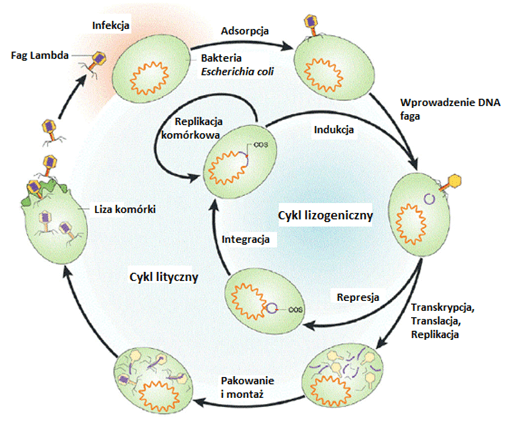
Cykl lityczny
Fagi przeprowadzające ten rodzaj cyklu są wykorzystywane w terapii fagowej. Cykl lityczny prowadzi do lizy komórki bakteryjnej. Przebiega w następujący sposób:
- Pierwszym krokiem jest adsorpcja do komórki bakterii. Bakteriofagi rozpoznają specyficzne receptory obecne na komórce bakteryjnej. Mogą to być białka, lipopolisacharydy (LPS), kwas tejchojowy, fimbrie, flagellum i inne cząsteczki. Po adsorpcji do powierzchni komórki następuje wstrzyknięcie materiału genetycznego faga do wnętrza komórki gospodarza. Kapsyd faga pozostaje na zewnątrz (taki „pusty” kapsyd nazywa się cieniem faga).
- Kiedy materiał genetyczny faga znajduje się już w cytoplazmie gospodarza, to dochodzi do przeprogramowania funkcji komórki gospodarza.
- Następuje gwałtowna replikacja materiału genetycznego faga a także ekspresja strukturalnych i funkcjonalnych białek fagowych. Następnie cząsteczki wirusa są składane i zostaje do nich spakowany kwas nukleinowy.
- Równocześnie pojawiają się holiny, spaniny i endolizyny, które po złożeniu wirusów w całość odpowiadają kolejno za zrobienie otworów w błonie komórkowej, destabilizację błony oraz przecięcie peptydoglikanu, aby uwolnić cząstki fagowe. Wtedy następuje liza komórki gospodarza.
Cykl lizogeniczny
W cyklu lizogenicznym po wniknięciu kwasu nukleinowego do komórki gospodarza następuje jego wbudowanie do chromosomu bakteryjnego. Jak do tego dochodzi?
- Tutaj za przykład posłuży bakteriofag lambda, który jest fagiem mogącym przechodzić zarówno cykl lityczny jak i lizogeniczny. Po przedostaniu się do cytoplazmy gospodarza bakteriofag przyjmuje formę kolistą.
- W swoim genomie zawiera gen int, którego produktem jest integraza. W genomie faga znajduje się miejsce nazywane attP a w chromosomie bakteryjnym attB. Jest to miejsce przyłączenia się faga. Następuje miejscowo specyficzna rekombinacja i insercja faga. Bakteriofag, który połączony jest w ten sposób z chromosomem gospodarza nazywa się profagiem.
- Profagi można zaindukować poprzez działanie m. in. mitomycyną C, światłem UV, czy H2O2, aby doprowadzić do wycięcia faga i rozpoczęcia cyklu litycznego.
Cykl pseudolizogeniczny
W cyklu pseudolizogenicznym po wniknięciu materiału genetycznego do komórki gospodarza fag staje się nieaktywną formą. Bakteriofag wybiera tę drogę w momencie, gdy źródła składników odżywczych są ograniczone i brakuje komórek gospodarza, w których fag mógłby się namnożyć. Powstaje długotrwała infekcja gospodarza a materiał genetyczny faga dzieli się asymetrycznie przy podziale komórkowym.
Cykl przewlekłej infekcji
Cykl przewlekłej infekcji jest charakterystyczny dla fagów filamentowatych (nitkowatych). W tym cyklu fagi namnażają się bez zabijania komórki gospodarza a czasem są także częścią życia bakterii. Przykładami takich fagów są M13 i fag Ff. W taki cykl mogą przejść profagi oraz fagi tworzące episom. Przy opisywaniu poszczególnych etapów skupimy się na fagach episomalnych [Ryc. 2.].

Przebieg cyklu przewlekłej infekcji
- Fagi takie pierwotnie rozpoznają receptory na pili bakterii, a ich drugim receptorem jest kompleks białkowy znajdujący się w błonie wewnętrznej komórki gospodarza. Białko pIII faga wiąże się dwiema N-końcowymi domenami do obu receptorów, C-końcowa domena jest zaangażowana w usuwanie płaszcza wirionu. Materiał genetyczny faga dostaje się do wnętrza gospodarza.
- Białka fagowe, które są zaangażowane w replikację, to pII, pV i pX i są obecne w cytoplazmie. Pozostałe białka są zlokalizowane w błonie komórki. Ponieważ fagi te kodują niewiele białek, to między innymi polimeraza DNA III, która jest potrzebna podczas replikacji, pochodzi od gospodarza.
- W system rozpoznania sygnału do pakowania zaangażowane są białka pVII, pIX i pI. Kompleks składania fagów składa się z ATPazy/kanału białek pI/pXI i kanału błony wewnętrznej pIV.
- pIV tworzy beczkowaty kanał złożony z 3 pierścieni. Jest on na tyle duży, że zmieszczą się w nim pojedyncze fagi i mogą przejść przez błonę zewnętrzną wydostając się na zewnątrz. W przypadku faga M13 miano jakie może uzyskać to nawet 1013/mL.
Literatura
- Tomasz Olszak, Agnieszka Latka, Bartosz Roszniowski, Miguel A. Valvano i Zuzanna Drulis-Kawa1 (2017). Phage Life Cycles Behind Bacterial Biodiversity. Current Medicinal Chemistry, 24: 3987-4001, DOI: 10.2174/0929867324666170413100136
- Michael G Rossmann, Vadim V Mesyanzhinov, Fumio Arisaka I Petr G Leiman (2004). The bacteriophage T4 DNA injection machine. ELSEVIER, 14: 171-180, DOI: 10.1016/j.sbi.2004.02.001
- Casjens SR, Hendrix RW (2015). Bacteriophage lambda: Early pioneer and still relevant Virology, 479-480:310-30, DOI: 10.1016/j.virol.2015.02.010.
- Sylvain Gandon (2016). Why Be Temperate: Lessons from Bacteriophage λ. Trends in Microbiology, 24(5):356-365, http://dx.doi.org/10.1016/j.tim.2016.02.008
- Allan Campbell (2003). The future of bacteriophage biology. Nature.Reviews Genetics, 4(6):471-7, DOI: 10.1038/nrg1089
- Rakonjac, J., Bennett, N. J., Spagnuolo, J., Gagic, D., & Russel, M. (2011). Filamentous bacteriophage: biology, phage display and nanotechnology applications. Current issues in molecular biology, 13(2), 51-76. DOI:10.21775/cimb.013.051