Plon fagowy uzyskany w wyniku cyklu litycznego musi uwolnić się z komórki bakteryjnego gospodarza i dzieje się to na dwa sposoby. U większości fagów, te których genom jest większy, zachodzi to z wykorzystaniem systemu holina-endolizyna. W przypadku fagów o mniejszym genomie ściana komórkowa bakterii jest niszczona za pomocą amuryn.
Spis treści
Opis amuryn
Amuryny to białka, które nie posiadają aktywności muralitycznej, ale doprowadzają do dezintegracji peptydoglikanu (ważnego komponentu ściany komórkowej bakterii). Równocześnie mówi się o nich, że są produktami pojedynczego genu lizy (ang single-gene lysis – Sgl) (Ryc. 1). Białka te są kodowane przez gen obecny u fagów posiadających małe genomy zbudowane z pojedynczej nici DNA, albo RNA (ssDNA i ssRNA, ss od ang. single stranded) [1].
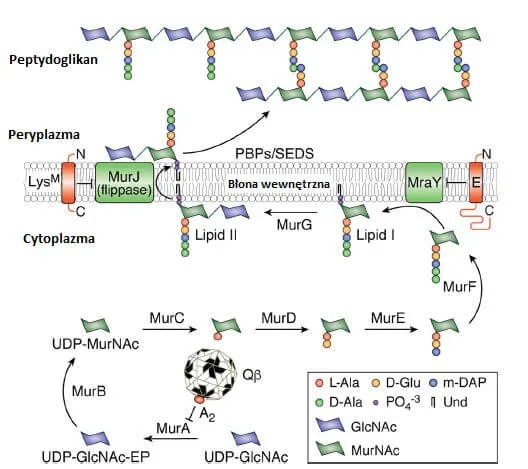
Przykładem faga ssDNA, który koduje amurynę jest bakteriofag phiX174, którego genom ma wielkość 5,4 kb (kilo par zasad). Z kolei przykładami fagów ssRNA są kolifagi jak QB i MS2 [2]
Do tej pory nie poznano zbyt wiele amuryn. Póki co można rozróżnić 3 typy tych białek. Białko E faga phiX174, białko A2 z faga QB i białko L z faga MS2 [1, 2].
Model działania białka E faga phiX174
Według tego modelu białko E ingeruje w syntezę peptydoglikanu. Z kolei na podstawie badań niektórych innych grup stwierdzano, że to białko działa przez aktywację niezidentyfikowanych funkcji autolitycznych, albo przez tworzenie tuneli transbłonowych pozwalających na uwlonienie cytozolu a także wirionów potomnych poza komórkę bakteryjną [1, 2].
Badania pokazały, że działanie białka E jest zależne od cytoplazmatycznego białka opiekuńczego SlyD. Bez białka opiekuńczego E nie mogło akumulować się w błonie komórkowej. Wykazano, że SlyD nie tylko stabilizuje białko E, ale i chroni przed proteolizą [3]. Ostatnie badania pokazały też, że białko E wchodzi w integrację z integralnym białkiem błonowym MraY, co hamuje syntezę peptydoglikanu [2].
Działanie białka A2 faga QB
Białko A2 pełni bardzo wiele funkcji, w tym funkcję białka litycznego. Badania wykazały, że białko A2 wchodzi w interakcję z białkiem MurA (enzym potrzebny na samym początku biosyntezy peptydoglikanu) doprowadzając do zahamowania syntezy peptydoglikanu. Za funkcję lityczną białka A2 odpowiada 180 pierwszych reszt w nim występujących [2].
Działanie białka L faga MS2
Białko L jest kodowane przez gen L, który w sekwencji genomu bakteriofagowego występuje jako czwarty. To białko jest 75-aminokwasowym polipeptydem o kwasowym charakterze. Wykazano, że 36 aminokwasów występujących w białku na N-końcu. W porównaniu do poprzednich białek, białko L działa trochę inaczej. Białko L indukuje autolizę, działa jako peptyd, który rozrywa błonę. Lokalizuje się między błoną zewnętrzną a wewnętrzną. Dokładny mechanizm działania wciąż nie jest poznany [2, 4].
W przypadku amuryn, które występują rzadziej niż holiny i endolizy jeszcze wiele drzwi do wyważenia stoi przed naukowcami. Jeśli w kolejnych latach ukarze się więcej badań na ich temat, to z pewnością nowe informacje zostaną tu dodane.
Literatura
- Grabowski, Ł., Łepek, K., Stasiłojć, M., Kosznik-Kwaśnicka, K., Zdrojewska, K., Maciąg-Dorszyńska, M., … & Węgrzyn, A. (2021). Bacteriophage-encoded enzymes destroying bacterial cell membranes and walls, and their potential use as antimicrobial agents. Microbiological Research, 248, 126746. DOI: 10.1016/j.micres.2021.126746
- Chamakura, K., & Young, R. (2019). Phage single-gene lysis: Finding the weak spot in the bacterial cell wall. Journal of Biological Chemistry, 294(10), 3350-3358. DOI: 10.1074/jbc.TM118.001773
- Mezhyrova, J., Martin, J., Peetz, O., Dötsch, V., Morgner, N., Ma, Y., & Bernhard, F. (2021). Membrane insertion mechanism and molecular assembly of the bacteriophage lysis toxin ΦX174‐E. The FEBS journal, 288(10), 3300-3316. DOI: 10.1111/febs.15642
- Chamakura, K. R., Edwards, G. B., & Young, R. (2017). Mutational analysis of the MS2 lysis protein L. Microbiology, 163(7), 961. DOI: 10.1099/mic.0.000485